Polaridade das Moléculas
Como já todos sabemos, os átomos, de acordo com o modelo atómico actual, possuem uma nuvem eletrónica em torno do seu núcleo. Essa nuvem vai-se tornando menos densa à medida que se afasta do núcleo, ou seja, vai-se tornando cada vez menos provável encontrar eletrões.
O modelo actual diz-nos também que as moléculas, que são formadas por 2 ou mais átomos (diferentes ou iguais), possuem apenas uma única nuvem eletrónica:
Nas figuras acima podemos observar dois tipos de moléculas quanto à sua polaridade:
- A molécula de Hidrogénio é composta por 2 átomos do mesmo elemento, logo, a nuvem eletrónica é igual junto de cada átomo. Diz-se, por isso, que a molécula não apresenta pólos, sendo apolar;
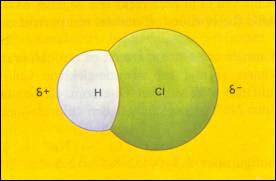
- Já a molécula de Cloreto de Hidrogénio, composta por átomos de diferentes elementos químicos, possui uma nuvem eletrónica mais densa nas proximidades do átomo de cloro, que é um átomo maior(em termos de tamanho), logo apresenta um pólo mais negativo que outro. Diz-se que este tipo de moléculas são polares;
Com moléculas que possuem 3 ou mais átomos, se forem formadas por átomos do mesmo elemento químico são apolares, se não podem ser tanto polares como apolares (exemplo Dióxido de Carbono).
Geometria Molecular
A geometria das moléculas, ou seja, a forma como são representadas, depende da distribuição dos átomos pelo espaço, não do tipo de átomos que a constituem.
- As moléculas diatómicas apresentam todas geometria linear, ou seja, as ligações estão perfeitamente alinhadas, não formando ângulos:
- As moléculas triatómicas podem apresentar geometria linear ou geometria ângular (quando as moléculas formam ângulos com menos de 180º):
- As moléculas tetratómicas(compostas por 4 átomos) podem apresentar geometria triangular plana se as ligações se encontrarem no mesmo plano, formando ângulos de 120º entre si, ou geometria piramidal quando o núcleo não se encontrar no mesmo plano que os restantes átomos:
- Por último, as moléculas pentatómicas (compostas por 5 átomos) apresentam geometria tetraédrica, na qual o núcleo ocupa o centro de um tetraedro cujos vértices correspondem aos núcleos de outros 4 átomos, formando entre si ângulos de 109º aproximadamente:
Ligações Químicas
Como viste agora, os átomos unem-se para formar moléculas que podem ser polares ou apolares, lineares ou tetraédricas.
Estas moléculas são mais estáveis que os átomos separados uns dos outros, porque os electrões dos átomos instáveis passam a ser compartilhados quando estes se ligam, preenchendo assim o último nível de energia, logo, maior estabilidade.
A este tipo de ligação química chama-se ligação covalente e só pode ser feita entre átomos de elementos não-metais. A ligação pode ser:
- Simples, quando há a partilha de 1 par de eletrões;
- Dupla, quando há a partilha de 2 pares de eletrões;
- Tripla, quando há a partilha de 3 pares de eletrões;
Podes representar esta ligação através de 2 formas:
- Notação de Lewis, que consiste em rodear os símbolos químicos dos átomos constituintes da molécula por pontos ou cruzes, ligando depois eletrões consoante o necessário:

2. Fórmula de estrutura, semelhante à representação acima, mas com traços a
substituir cruzes e pontos:
Como foi referido, a ligação covalente ocorre entre não-metais, ou seja, entre átomos com tendência a captar eletrões. Existe outro tipo de ligação que ocorre entre átomos com tendência a captar eletrões e outros com tendência a perdê-los, entre átomos de elementos metálicos e átomos de elementos não-metálicos, a ligação iónica.
Neste tipo de ligação, os átomos com tendência a captar eletrões formam iões negativos, os que têm tendência a perdê-los formam iões positivos.
A representação da ligação iónica pode também ser feita através da Notação de Lewis:
Existe ainda outra ligação, que ocorre entre átomos cujos eletrões têm tendência a libertar-se, ou seja, ocorre entre átomos de elementos metálicos. É a ligação metálica.
Os átomos deste tipo de elementos possuem poucos eletrões de valência que, quando se libertam, formam um "mar de eletrões livres, no qual estão mergulhados iões positivos.